SFX(結晶構造解析)
連続フェムト秒結晶構造解析(SFX)の共用実験装置として、DAPHNIS(Diverse Application Platform for Hard X-ray diffractioN In SACLA)が利用可能です。
基本性能・成果
DAPHNISの基本性能
| 回折像取得レート | 30 Hz |
| 検出器距離 | 50 - 150 mm |
| 検出エリア | ~110 ⅹ 110 mm2 |
| 到達可能分解能 @10 keV | 1.5 Å (検出エリア内接円上において ) |
| ヒット率 | 典型的な値として20–30% (高粘度試料インジェクタ利用時) |
| インデックス率 | 典型的な値として60–70% |
| 解析に利用される回折像の数 (分子置換法の場合) |
<1 ⅹ 104 (静的構造解析) ~2 ⅹ 104 (ポンププローブ計測) |
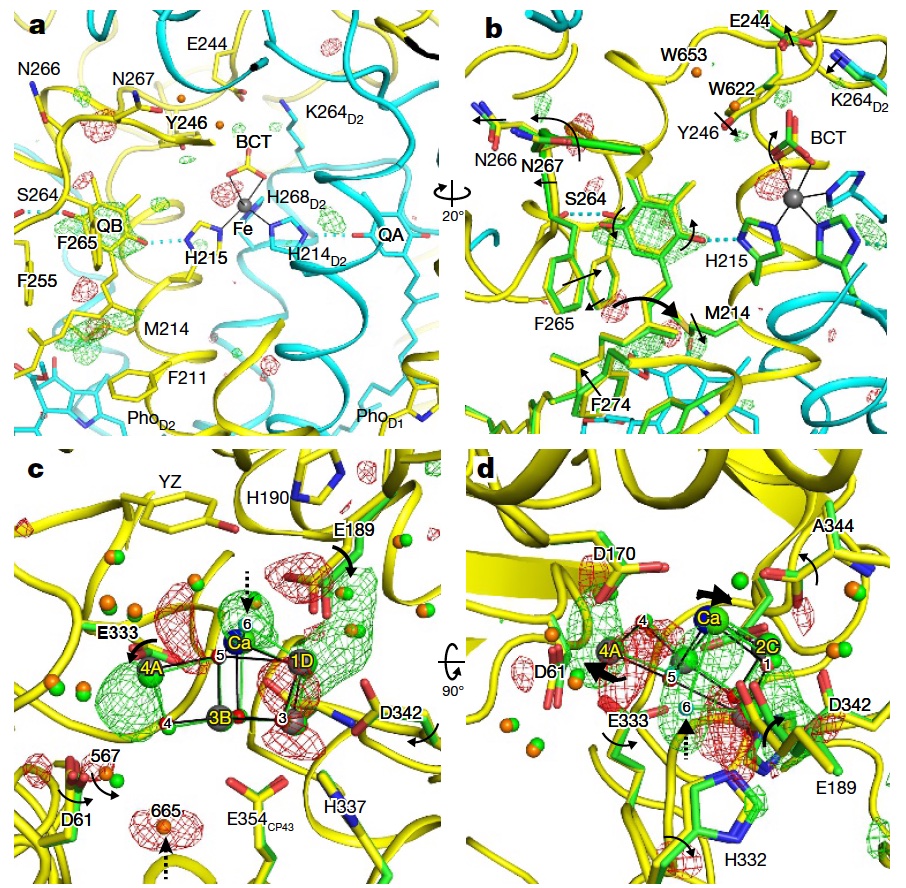
光化学系II複合体の反応中間体の構造を解明
SACLAのX線短パルスを使用することで、光化学系II 複合体 (PSII) の水分解反応サイクルにおける中間体の構造を捉えることに成功しました。
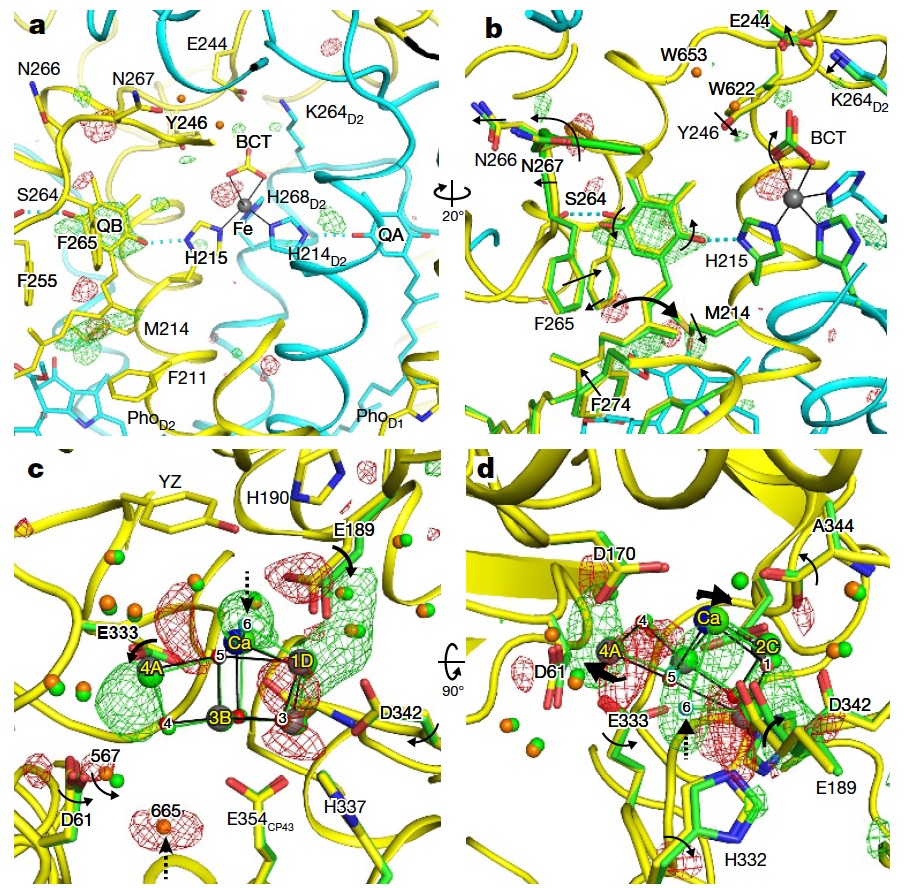
Isomorphous difference Fourier map
参考文献:
M. Suga et al., Nature 543, 131 (2017).
バクテリオロドプシンが光吸収後に構造を変化させる様子を捉え、水素イオンを輸送する仕組みを解明
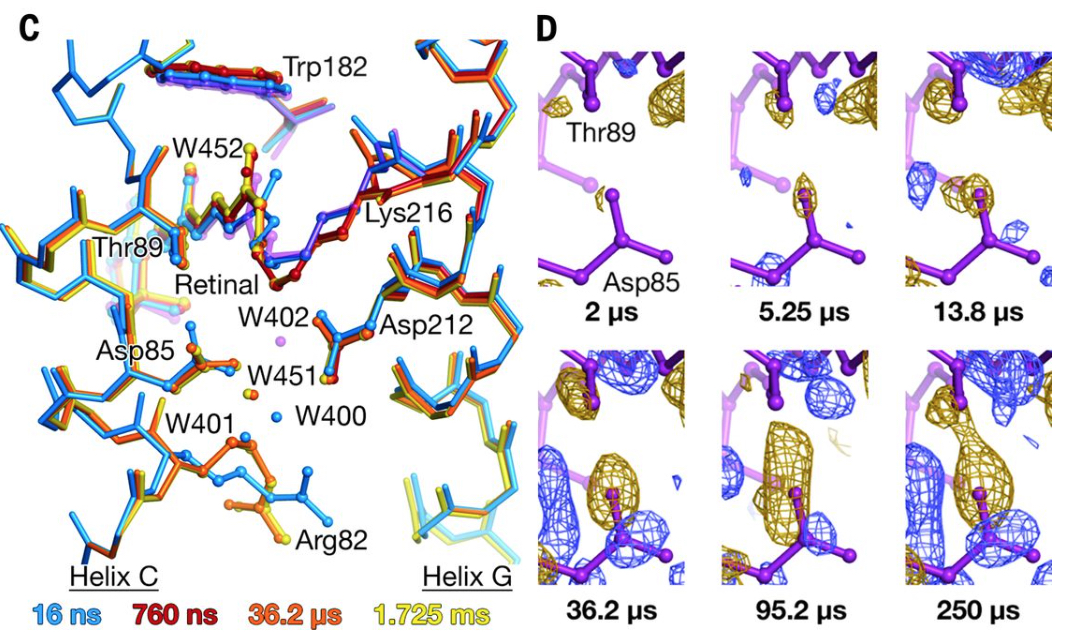
Crystallographic structural models of bR/Close-up view of difference electron density across the Asp85-Thr89 H bond
実験装置
DAPHNIS[1]
蛋白質結晶などの試料を流体のキャリアに分散させ、 インジェクターからXFELの照射野に送り込み、試料の回折像をパルス毎に記録します。
光学レーザーを利用したポンプ・プローブ実験にも対応可能です[2]。
試料の性質に応じてインジェクターを選択することができ、液体ジェットインジェクター、高粘度キャリア用インジェクター[3]、液滴型インジェクター[4]を利用することができます。
また、これらの標準品以外のインジェクターをユーザーが持ち込んで、 本機に接続しながら実験を行うことも可能です。その場合、DAHPNIS標準のホルダーで保持できるように作成をお願いいたします。
嫌気条件が必要な試料には、クローズドタイプのDAPHNISが利用できます。
どちらもMPCCD検出器もしくはRayonix検出器(MX-300HS)と組合わせて測定システムを構成します。
※SFX実験システムは、X線自由電子レーザー 重点戦略研究課題 、科研費・新学術領域「高速分子動画」、SACLA基盤開発プログラムの支援を受け、京都大学を中心とするグループとの共同開発により整備されました。
参考文献
[1] K. Tono et al., J. Synchrotron Rad. 22, 532 (2015).
[2] M. Kubo et al., J. Synchrotron Rad. 24, 1086 (2017).
[3] Y. Shimazu et al., J. Appl. Cryst. 52, 1280 (2019).
[4] F. Mafuné et al., Acta Cryst. D72, 520 (2016).
図面
オープンタイプ 1, 2
クローズドタイプ 1, 2
標準インジェクター
インジェクター取り付け部
検出器
DAPHNISを使用したSFX実験では、Octal-MPCCDまたはRayonix(MX-300HS)を検出器として用いることができます。Octal-MPCCDを用いた場合、試料-検出器間の標準的な距離は約50 mmです。
また、試料位置から約18 mm下流にX線ビームストップが設置されています。ビームストップはΦ1.5 mm, Φ2 mm, Φ3 mmの3種類から選ぶことが可能です。
ソフトウェア
多くの場合、実験で取得したデータは、SACLA HPC (High Performance Computing)システムを用いて解析します。詳細はSACLA HPC Portal site (HPCアカウントによるVPN接続が必要です)をご参照ください。
回折像のリアルタイムデータ処理ソフトとして、Cheetah[5]やCrystFEL[6]がSACLAでも使用可能です[7]。
参考文献
[5] A. Barty et al., J. Appl. Cryst. 47, 1118 (2014).
[6] T. White et al., J. Appl. Cryst. 49, 680, (2016).
[7] T. Nakane et al., J. Appl. Cryst. 49, 1035 (2016).
励起レーザーについて
励起光源として、波長可変ナノ秒レーザーもしくは波長可変フェムト秒レーザーが使用できます。利用可能な波長範囲、パルス時間幅、パルスエネルギーについては、下記「運転パラメータ」の中の「光学特性」をご参照ください。ナノ秒レーザーはEH3(BL2)、フェムト秒レーザーはEH2(BL3)での実験となります。
励起レーザーの集光は、光ファイバー+対物レンズによる2方向励起(オープンタイプのみ)、もしくは平凸レンズによる1方向励起(オープンタイプ、クローズドタイプ)となっております。
励起レーザーの空間プロファイルはガウシアンプロファイルです。

運転パラメータ(EH3@BL2)
XFELパラメータ
| 光子エネルギー(基本波) | 4-20 keV |
| パルスエネルギー | 光子エネルギーに依存(下図参照) |
| エネルギー幅(ΔE/E) | ~0.5%(ニ結晶分光器なし) |
| 繰り返しレート | 30 Hz(BL2&3同時運転時) |
参考文献:
M. Yabashi et al., J. Synchrotron Rad. 22, 477 (2015).
K. Tono et al., J. Synchrotron Rad. 26, 595 (2019).
(参考)光子エネルギーとパルスエネルギー・光子数の関係(BL3の場合)
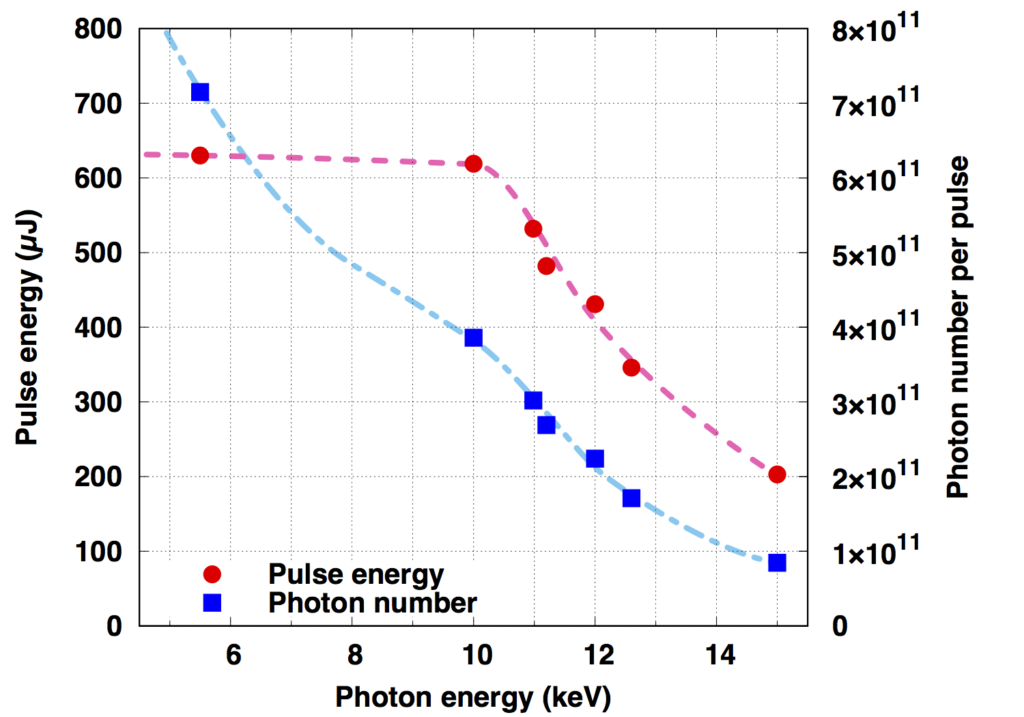
X線集光特性
| Optical parameters (KB mirrors) |
Vertical | Horizontal |
| Surface coating | Rhodium | Rhodium |
| Substrate size | 600 × 50 × 50 mm | 600 × 50 × 50 mm |
| Glancing angle (2 mrad/4 mrad)* | 2.1/3.8 mrad | 2.0/3.7 mrad |
| Focal length | 1.95 m | 1.30 m |
| Distance from source | 140.00 m | 140.65 m |
| Spatial acceptance (2 mrad/4 mrad)* | >1.2/>2.2 mm | >1.1/>2.1 mm |
| Divergent angle (2 mrad/4 mrad)* | ~0.65/~1.2 mrad | ~1.0/~1.7 mrad |
| Typical focal size @ 10 keV | ~1 µm FWHM | ~1 µm FWHM |
*高エネルギー領域では2 mrad系、低エネルギー領域では4 mrad系を利用する。
光学レーザー特性
| グリーンレーザー Minilite, Continuum |
光パラメトリック発振器* NT232, Ekspla |
|
| Wavelength | 532 nm | 532 nm |
| Max. Pulse Energy | ~20 µJ | 波長に依存(下図参照) |
| Pulse Duration | 3-5 ns | 2-5 ns |
| Rep. Rate | 10 Hz | 30 Hz |
*光パラメトリック発振器(OPO: Optical Parametric Oscillator)のパルスエネルギーは波長に依存します。
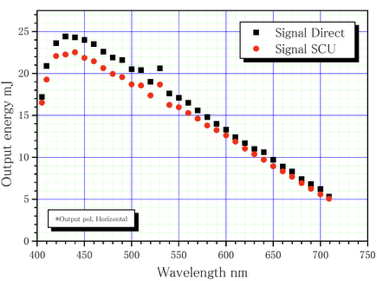
※フェムト秒レーザーを利用する場合は、EH2@BL3で実施可能です。
実験セットアップ手順
ビームタイム前までにSACLAのスタッフが行うこと
以下の作業はビームタイム前にSACLAのスタッフが行います。
- ・装置を実験ハッチに搬入。
- ・XFELのスペクトル測定、光軸調整。
- ・XFEL集光光学系の調整。
同期レーザーを使用するポンプ・プローブ型実験の場合は、以下の作業も SACLAのスタッフが行います。
- ・同期レーザースペクトル、光軸、集光の調整。
- ・XFELと同期レーザーの位置合わせ。
- ・高速PDを使ったXFELと同期レーザーのタイミング調整。
- ・フェムト秒レーザー使用の場合は、続いてフェムト秒精度でのタイミング調整も行います。
ビームタイム開始後にユーザー自身が行う主な操作
SFX実験を行うために、ユーザー自身に行っていただく実験操作を以下に示します。
- ・試料調整、試料ホルダーへの装填。
- ・試料交換とそれに伴うインジェクターの取り付け、位置調整。
- ・試料吐出の最適化
- ・標準試料を用いた計測。
- ・インジェクターおよび吸引機のクリーニング。
- ・測定および解析
試料調整
各種準備室について
来所後に試料を作製される方は以下の準備室を使用可能です。調整に必要な薬品類はご持参ください。また実験廃液や化学薬品の付着した廃棄物などはお持ち帰りいただき、各所属機関で廃棄していたきますよう、ご協力をお願いいたします。
ガス、揮発性強酸などドラフトが必要な試料調整には、SACLAの測定準備室はご利用いただけません。SPring-8サイト内の化学試料準備室をご使用ください。化学試料準備室をご利用の際には、来所10日前までの申し込みが必要です。また、化学試料準備室および生物試料準備室は、SPring-8ユーザーも利用する共同実験室です。
利用方法は各準備室のホームページをご参照ください。
- ・測定準備室4(SACLA実験ホール内)
室温:20 ℃程度、暗室可 - ・化学試料準備室
http://www.spring8.or.jp/ext/ja/chem_pre/ - ・生物試料準備室
http://www.spring8.or.jp/ext/ja/bio_pre/ - ・低温室(4℃)や嫌気性チャンバーの利用を希望される方はご相談ください。
SFX (Crystal Structure Analysis)
DAPHNIS (Diverse Application Platform for Hard X-ray diffractioN In SACLA) is a shared experimental device available for continuous femtosecond crystal structure analysis (SFX).
Basic Performance and Results
Basic DAPHNIS performance
| Diffraction image acquisition rate | 30 Hz |
| Detector distance | 50 mm |
| Detection area | ~110 ⅹ 110 mm2 |
| Obtainable resolution @10 keV | 1.5 Å (On the inscribed circle detection area) |
| Hit rate | Typical value 20–30% (When using high-viscosity sample injectors) |
| Index rate | Typical value 60–70% |
| Number of diffraction images used for analysis (With the molecular replacement method) |
<1 ⅹ 10>4 (Static structure analysis) ~2 ⅹ 104 (Pump-Probe measurements) |
Structure analysis of the reaction intermediates of the Photosystem II Complex
By using the short X-ray pulses from SACLA, the capture of the structure of the intermediates in the photosystem II complex (PSII) hydrolysis reaction cycle was successfully performed.
Isomorphous difference Fourier map
References:
M. Suga et al., Nature 543, 131 (2017).
To analyze the mechanisms of transporting hydrogen ions by understand how bacteriorhodopsin changes structure after absorbing light.
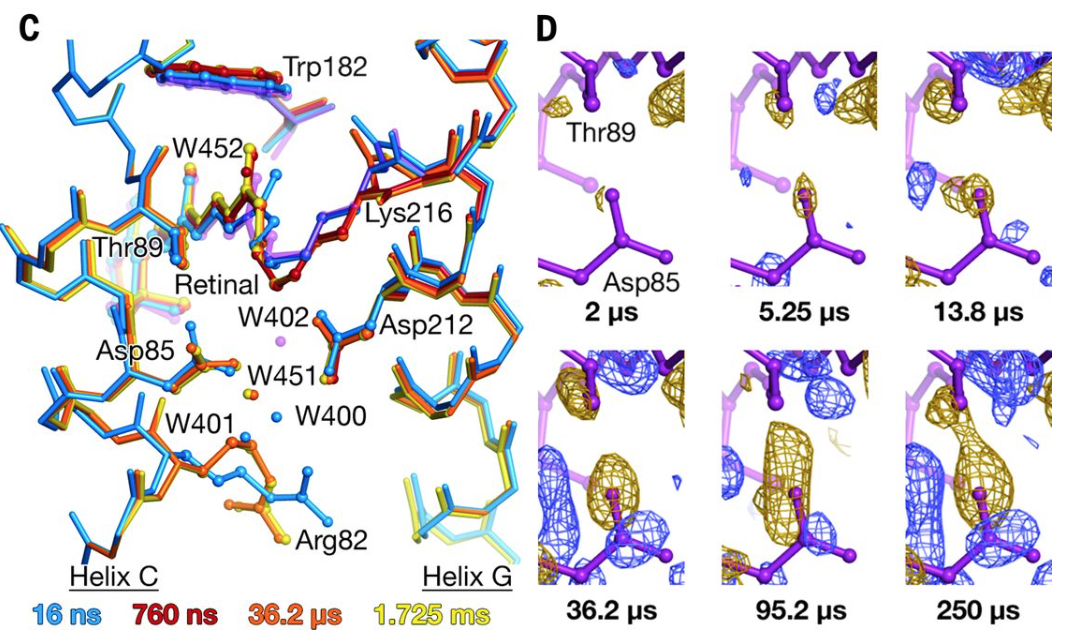
Crystallographic structural models of bR/Close-up view of difference electron density across the Asp85-Thr89 H bond
References:
E. Nango et al., Science, 354, 1552 (2016).
Experimental Equipment
DAPHNIS[1]
Samples, such as protein crystals, are dispersed in a fluid carrier then sent from the injector to the XFEL irradiation field, and the diffraction images of the sample are then recorded for each pulse.
This can also be used for pump-probe experiments using optical lasers [2].
The injectors can be selected according to the nature of the sample, and can be chosen from and liquid jet injectors, high-viscosity carrier injectors [3], and droplet injectors [4].
In addition, it is also possible for the user to bring in injectors other than the standard products and conduct experiments while connected to this unit. In that case, please ensure that it can be held in the DAPHNOS standard holder.
Closed-type DAPHNIS can be used for samples that require anaerobic conditions.
Both are combined with an MPCCD detector or a Rayonix detector (MX-300HS) to form the measurement system.
※The SFC experimental system was established as a joint development, with Kyoto University playing a leading role, to pursue X-ray Free Electron Laser priority strategy research, receiving support from grants in aid for scientific research for new academic areas in "high speed molecular movies", as well as from the SACLA Basic Development Program.
References:
[1] K. Tono et al., J. Synchrotron Rad. 22, 532 (2015).
[2] M. Kubo et al., J. Synchrotron Rad. 24, 1086 (2017).
[3] Y. Shimazu et al., J. Appl. Cryst. 52, 1280 (2019).
[4] F. Mafuné et al., Acta Cryst. D72, 520 (2016).
Diagram
Open-type1, 2
Closed-type1, 2
Standard injector
Injector mount
Detector
For SFX experiments using DAPHNIS, both the Octal-MPCCD or the Rayonix(MX-300HS) detector can be used. When using the Octal-MPCCD, the standard distance between the sample and the detector is approximately 50 mm.
In addition, an X-ray beam stop is installed approximately 18mm downstream from the sample position. The beam stop can be selected from three types: Φ1.5 mm, Φ2 mm, and Φ3 mm.
Software
In most cases, the data obtained in the experiment is analyzed by using the SACLA HPC (High Performance Computing) system. For more information, please see the SACLA HPC Portal site (This requires a VPM connection with an HPC account).
The Cheetah[5] and CrystFEL[6] can also be used with SACLA real-time data processing software for diffraction imaging[7].
References:
[5] A. Barty et al., J. Appl. Cryst. 47, 1118 (2014).
[6] T. White et al., J. Appl. Cryst. 49, 680, (2016).
[7] T. Nakane et al., J. Appl. Cryst. 49, 1035 (2016).
About the excitation lasers
A tunable nanosecond laser, or a tunable femtosecond laser can be used as the excitation source. For the available wavelength ranges, pulse time widths, and pulse energies, please refer to the “optical characteristics” section in the “operating parameters” below. The nanosecond laser is used with experiments in EH3(BL2), and the femtosecond laser is used with experiments in EH2(BL3).
The excitation laser is focused by two-way excitation (open-type only) with optical fiber and an objective lens, or one-way excitation (open-type and closed-type) with a plano-convex lens.
The spatial profile of the excitation laser is the Gaussian profile.

| Focusing distance (Full width at half maximum) |
Maximum pulse energy | |
| Φ100 μm fiber | ~40 μm | ~8 μJ/pulse* |
| Φ200 μm fiber | ~90 μm | ~10 μJ/pulse* |
| Φ400 μm fiber | ~240 μm | ~25 μJ/pulse* |
| plano-convex lens(f~200 mm) | ~150-200 μm | Maximum energy at each wavelength** |
*Limitations due to damaged optical fibers
**See the optical laser characteristics
Operating Parameters(EH3@BL2)
XFEL parameters
| Photon energy (Fundamental wave) | 4-20 keV |
| Pulse energy | For photon energy (see figure below) |
| Energy width(ΔE/E) | ~0.5%(Without a two crystal spectrometer) |
| Repetition rate | 30 Hz(BL2&3 simultaneous operation) |
References:
M. Yabashi et al., J. Synchrotron Rad. 22, 477 (2015).
K. Tono et al., J. Synchrotron Rad. 26, 595 (2019).
(Reference) The relationship between photon energy and pulse energy / the number of photons (In the case of BL3)
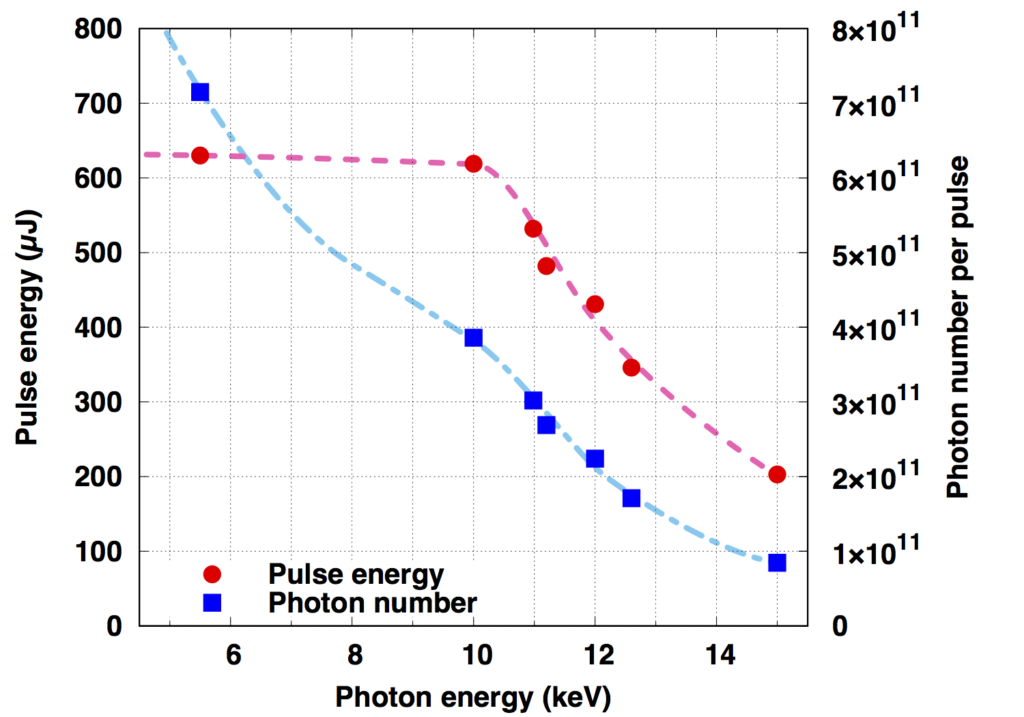
X-ray focusing characteristics
| Optical parameters (KB mirrors) |
Vertical | Horizontal |
| Surface coating | Rhodium | Rhodium |
| Substrate size | 600 × 50 × 50 mm | 600 × 50 × 50 mm |
| Glancing angle (2 mrad/4 mrad)* | 2.1/3.8 mrad | 2.0/3.7 mrad |
| Focal length | 1.95 m | 1.30 m |
| Distance from source | 140.00 m | 140.65 m |
| Spatial acceptance (2 mrad/4 mrad)* | >1.2/>2.2 mm | >1.1/>2.1 mm |
| Divergent angle (2 mrad/4 mrad)* | ~0.65/~1.2 mrad | ~1.0/~1.7 mrad |
| Typical focal size @ 10 keV | ~1 µm FWHM | ~1 µm FWHM |
*The 2 mrad system is used in the high-energy region, and the 4 mrad system is used in the low-energy region.
Optical laser characteristics
| Green Laser Minilite, Continuum |
Optical parametric oscillator* NT232, Ekspla |
|
| Wavelength | 532 nm | 532 nm |
| Max. Pulse Energy | ~20 µJ | Wavelength dependent (see figure below) |
| Pulse Duration | 3-5 ns | 2-5 ns |
| Rep. Rate | 10 Hz | 30 Hz |
*The pulse energy of the optical parametric oscillator (OPO) depends on the wavelength.
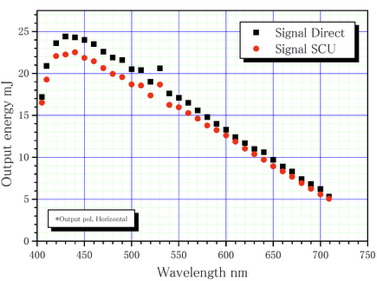
※When using a femtosecond laser, EH2@BL2 can be performed by a single machine.
Steps for the Experimental Setup
What the SACLA staff do before the beamtime
The following tasks are performed by the SACLA staff before the beam time.
- ・Deliver the equipment to the experimental hatch.
- ・Adjust the XFEL spectral measurement and optical axis.
- ・Adjust the XFEL focusing optical systems.
For pump-probe experiments which use synchronous lasers, the SACLA staff will also perform the following tasks:
- ・Focus and adjust the synchronous laser spectrum and the optical axis.
- ・Match the XFEL and the synchronous laser.
- ・Adjusting the timing of the XFEL and synchronous laser by using high-speed PD.
- ・When using femtosecond lasers, timing adjustment with femtosecond accuracy is also performed.
Main operations performed by the user at the start of the beam time
In order to conduct SFX experiments, the following are the experimental operations that the user must perform.
- ・Sample adjustment and loading the sample into the sample holder.
- ・Sample exchange and associated injector mounting and positioning.
- ・Optimization of the sample discharge.
- ・Perform the measurements using standard samples.
- ・Clean the injectors and absorption machines.
- ・Perform the measurement and analysis.
Sample Adjustment
About various preparation rooms
If you are preparing a sample after coming to the office, the following preparation rooms can be used. Please bring the necessary chemicals for the adjustments. In addition, please take all experimental waste liquid and waste materials with you and dispose of them at your affiliated institution.
The measurement preparation room at SACLA is not available for sample adjustments that require drafting of gasses and volatile strong acids. Please use the chemical sample preparation room at the SPring-8 site. When using the chemical sample preparation room, you must apply at least 10 days prior to your visit. The chemical sample preparation room and the biological sample preparation room are joint laboratories, which are also used by SPring-8 users.
- ・Measurements in Preparation room 4 (In the SACLA experiment hall)
Room temperature: 20 ℃, available as a dark room - ・Chemical sample preparation room
http://www.spring8.or.jp/ext/ja/chem_pre/ - ・Biological sample preparation room
http://www.spring8.or.jp/ext/ja/bio_pre/ - ・If you would like to use a low-temperature room (4℃)or anaerobic chamber, please contact us.
