概日リズムを奏でる時計タンパク質の内部で「2つの歯車」が噛み合う仕組み
2022年4月16日
自然科学研究機構分子科学研究所
東海国立大学機構名古屋大学
大阪大学 蛋白質研究所
自然科学研究機構 分子科学研究所・協奏分子システム研究センターの古池美彦助教、向山厚助教、秋山修志教授、欧陽東彦研究員、総合研究大学院大学・後期博士課程のDamien SIMONさん、名古屋大学大学院理学研究科/高等研究院の伊藤(三輪)久美子特任助教、近藤孝男特別教授、大阪大学・蛋白質研究所の山下栄樹准教授らの研究グループは、シアノバクテリアの時計タンパク質KaiCの立体構造を解明し、24時間周期のリズムを生み出す2種類の化学反応の連携を原子レベルで解明しました。 論文情報 |
研究の背景
生命は、地球の自転が生み出す約24時間(概日)周期の環境変化に適応しています。このリズムを支えているのが「概日時計(一般的には体内時計と呼ばれる)」と呼ばれるシステムで、バクテリア・植物・昆虫・哺乳類などの広い生物種に共通して見られる生命現象です。なかでもシアノバクテリアの概日時計は、細胞はもとより試験管内でも研究できる利点があり、生物学のみならず幅広い分野で研究対象となっています。これまでの研究をとおして、時計タンパク質(※1)が2種類の化学反応サイクルを連携させることで時刻情報を生み出していることが、明らかになっていました。しかしながら、時計タンパク質内の離れた部位で起こる2つの反応サイクルが、どのように連携しているかは分かっていませんでした。化学反応サイクルを歯車に例えると、それぞれ回転する2つの歯車が噛み合う仕組みが分かっていなかった、と言うことができます。
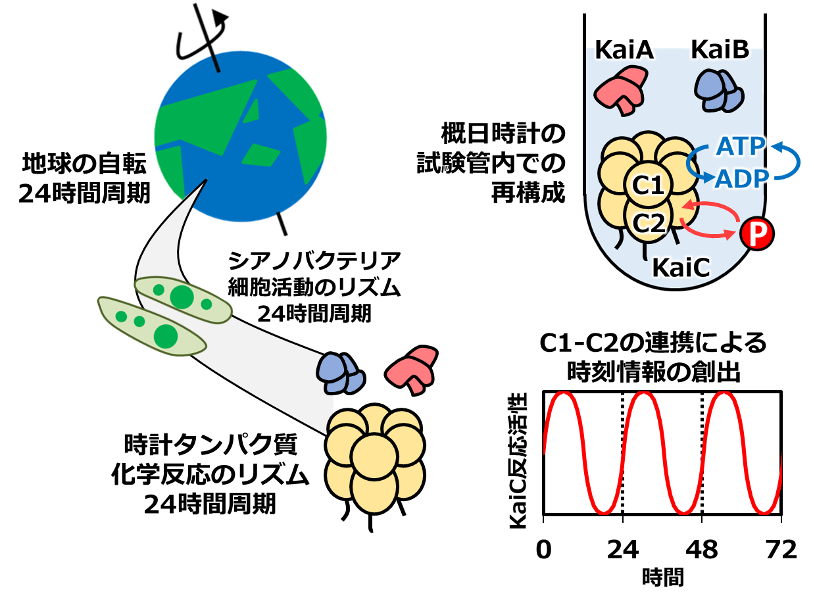
シアノバクテリアの概日時計は、3種類の時計タンパク質KaiA, KaiB, KaiCとアデノシン三リン酸(ATP)(※2)を試験管内で混ぜ合わせることで再構成できます(図1)。ペースメーカーとして働くKaiCに、その2つの歯車が組み込まれています。KaiCは二重リング構造になっており(C1リングとC2リング)、上部の歯車であるC1リングでは、ATP加水分解サイクルが進行します。ATPが分解されてアデノシン二リン酸(ADP)へと変換され、ADPがKaiC外部に抜けると、次のATPが取り込まれるという反応サイクルです(図1、ATP-ADPサイクルとして表記)。下部の歯車であるC2リングでは、リン酸化・脱リン酸化サイクルが進行します。特定のアミノ酸にリン酸基をリズミックに付けたり外したりする反応サイクルです(図1、赤丸Pの脱着サイクルとして表記)。
KaiCが表す時刻情報は、この2つのリングの状態を連携させることではじめて生み出されます。例えば、C1リングのみを改変してATP加水分解サイクルを加速・減速させると、C2リングのリン酸化・脱リン酸化サイクルも加速・減速されることが知られています。C1リングとC2リングが歯車として回転する様子を観察し、それらが互いに連携する仕組みを明らかにすることは、概日時計の仕組みを理解するうえで必要不可欠でした。
図1:シアノバクテリアの概日時計を駆動する時計タンパク質KaiC
研究の成果
研究グループは、KaiCが刻々と状態を変えながら(歯車を回しながら)時を計る仕組みを、原子レベルで明らかにすることを目標に研究を進めてきました。結晶化したKaiCを兵庫県・播磨の大型放射光施設SPring-8(BL44XU)に持ち込み、X線結晶構造解析(※3)を進めました。KaiCの立体構造を分析し、C1リングとC2リングがそれぞれ反応サイクルを進めながら連携する様子を捉えることに成功しました(図2)。
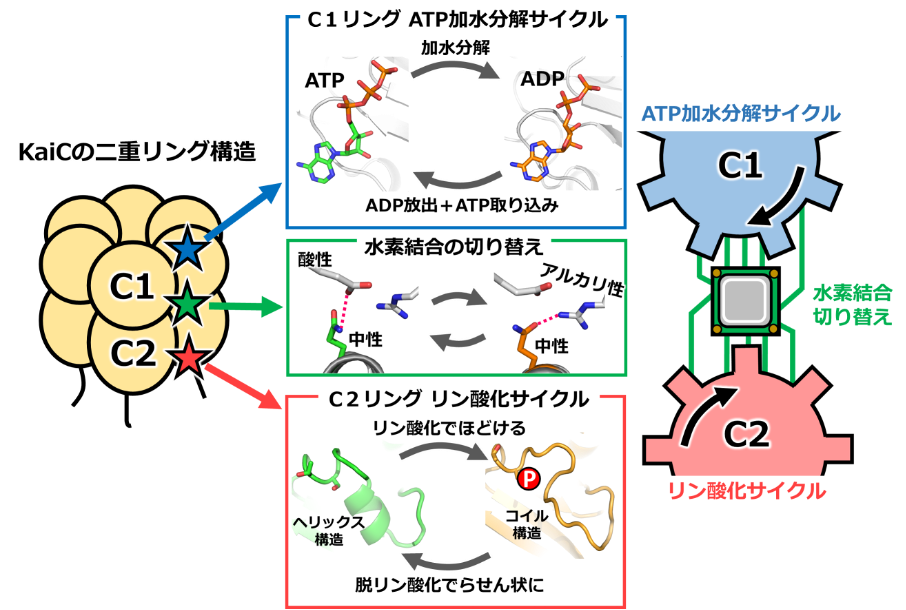
C1リングでは、ATPが分解される前の状態、分解されてADPとなった状態を、まざまざと観察することができました。C2リングでは、リン酸基の付け外しに伴って、アミノ酸の鎖(ペプチド鎖)がほどけた状態(コイル状態)とらせん状態(ヘリックス状態)の2つの状態を行き来することが分かりました。そして、C1リングでADPがATPに置き換わるときに、C2ではコイル状態からヘリックス状態へと変化することを発見しました。2つの歯車が連動する様子が、世界で初めて明らかになった瞬間でした。
研究者を驚かせたことは、C1リングとC2リングの連携には特別な仕掛けが必要で、それがあたかも「演算処理装置」のように振る舞っていたことでした。C1リング側にある酸性のアミノ酸とアルカリ性のアミノ酸のあいだを、C2リング側の中性アミノ酸が水素結合(※4)を切り替えながら行き来していました。中性アミノ酸を酸性やアルカリ性のアミノ酸へと改変して、結合の切り替えができないようにすると、KaiCは機能しなくなりました。この水素結合の切り替えはわずか0.1ナノメートルの領域で起こる極小かつ精密なもので、一方の歯車の進む速度や回転の度合いを読み取り、他方の歯車に伝える働きを、双方向的に行っているのです。
このように2つの歯車が噛み合うことで、KaiCは時刻情報を生み出します。C1リングには2つ以上の状態(ATP状態、ADP状態…等)があり、C2リングは2つの状態を行き来します(コイル状態、ヘリックス状態)。組み合わせとして少なくとも2×2=4通り以上の時刻情報を表すことができ、朝・昼・夕・夜などの区別が可能となるのです。このようにKaiCの内部で、ATP加水分解サイクル、リン酸化・脱リン酸化サイクルの2つの歯車と、それらを連携させる演算装置がタイミングを合わせて働くことで、シアノバクテリアの概日時計が駆動されることが分かりました。
図2:時計タンパク質KaiCの2つの歯車の構造
今後の展開・この研究の社会的意義
時計タンパク質の種類や構造は生物種によって異なりますが、複数の化学反応を組み合わせて時刻情報を生み出す点は共通しています。本研究が示すのは、化学反応に連動するタンパク質自身の構造変化や水素結合の切り替えに着目することで、概日時計の理解が格段に進むということです。KaiCが機能する原理をよりよく理解することで、似たような仕組みをもつ他の生物種の時計タンパク質の研究にも、その手法や考え方を応用することができます。
細胞のなかでは多種多様な生体物質がひしめき合っています。そのため、こうした分子内で完結する精密な制御システムの働きが重要となります。何週間も振動を続けるKaiCのような頑丈かつ精緻なタンパク質の仕組みを明らかにすることは、細胞の仕組みや生命の成り立ちを明らかにするうえで大切なことなのです。
用語解説
(※1)時計タンパク質
生物時計の機能を維持するために必須となるタンパク質の総称。時計タンパク質を変異させたり欠損させたりすると、生物の行動のリズム特性に様々な影響が現れる。
(※2)ATP
アデノシン三リン酸(Adenosine Triphosphate)の略称。筋肉収縮など細胞における様々な運動のエネルギー源として利用される物質のことを指す。生物のエネルギーの利用・貯蓄に用いられ、その重要性から「生体におけるエネルギーの通貨」とも呼ばれる。アデノシンという物質に3つのリン酸基が結合した形をしている。ATP加水分解は、水分子との反応によってリン酸基が外されて分解される反応で、アデノシン二リン酸(ADP)が生成される。リン酸化はリン酸基がATPからタンパク質のアミノ酸残基へと移る反応、脱リン酸化はアミノ酸残基に付与されたリン酸基が解離する反応。
(※3)X線結晶構造解析
分子の立体構造を明らかにするために用いられる解析手法のひとつ。原子や分子が3次元に配列した結晶にX線を照射し、回折されたX線の方向・強さを解析することで、電子の分布すなわち原子の配置についての情報を得ることができる。
(※4)水素結合
電気陰性度の大きいふたつの原子のあいだに水素原子が入って形成される化学結合。分子の骨格を構成する共有結合よりも結合エネルギーが小さく、切り替えが比較的容易。
研究グループ
分子科学研究所・協奏分子システム研究センター
名古屋大学・大学院理学研究科 / 高等研究院
大阪大学・蛋白質研究所
研究サポート
本研究は、科学研究費補助金No.17H06165, No.18K06171, No.19K16061等の助成を受けて実施されました。
研究に関するお問い合わせ先 |
研究に関するお問い合わせ先
氏名:古池美彦(ふるいけよしひこ)
所属、職位:分子科学研究所 助教
TEL:0564-55-7336
E-mail:furuike ims.ac.jp
ims.ac.jp
氏名:秋山修志(あきやましゅうじ)
所属、職位:分子科学研究所 教授
TEL:0564-55-7363
E-mail:akiyamas ims.ac.jp
ims.ac.jp
報道担当
自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当
TEL:0564-55-7209 FAX:0564-55-7374
E-mail:press ims.ac.jp
ims.ac.jp
東海国立大学機構 名古屋大学広報室
機構事務局総務部総務課広報グループ
TEL:052-789-3058 FAX:052-789-2019
E-mail:nu_research adm.nagoya-u.ac.jp
adm.nagoya-u.ac.jp
大阪大学蛋白質研究所 広報室
TEL:06-6879-4317(庶務係) FAX:06-6879-8590
E-mail:kouhou protein.osaka-u.ac.jp
protein.osaka-u.ac.jp
(SPring-8 / SACLAに関すること)
公益財団法人高輝度光科学研究センター
利用推進部 普及情報課
TEL:0791-58-2785
FAX:0791-58-2786
E-mail:このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。