「生命のエネルギー工場」を動かす仕組みをクライオ電子顕微鏡で解明!
2025年10月18日
京都産業大学
高輝度光科学研究センター
理化学研究所
大阪大学
京都工芸繊維大学
|
私たちが生きるために欠かせないエネルギー分子「ATP1)(アデノシン三リン酸)」。このATPを作り出すのが、細胞の中にある「ATP合成酵素2)」という巨大な膜タンパク質3)です。ATP合成酵素は、生体膜に埋め込まれ、水素イオンの流れを回転運動に変換し、その力でATPを合成するという、まるでナノサイズの発電機のような働きをしています。 |
■背景
私たちの細胞を包む「生体膜」には、無数の膜タンパク質が存在しています。これらは、栄養やイオンの出入りを制御したり、情報を伝えたりと、生命活動に欠かせない役割を担う重要な分子です。さらに、多くの薬はこの膜タンパク質を標的にして作用するため、その構造を正しく理解することは、新しい薬を設計するうえで不可欠です。
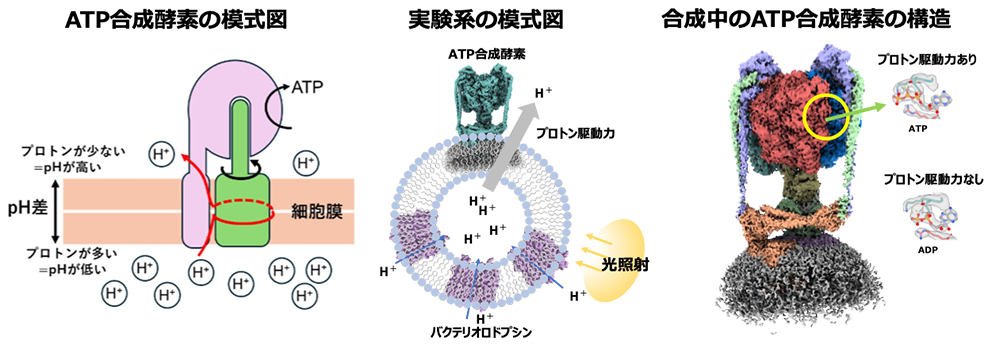
ATPは「生命のエネルギー通貨」と呼ばれ、私たちの細胞では生命のエネルギー工場であるミトコンドリアで作られます。このATPを生み出すのが、膜タンパク質であるATP合成酵素です。ATP合成酵素は、膜に埋まった部分と膜から突き出た部分からなる複雑な構造を持ち、膜内の部分では水素イオンの流れ(プロトン駆動力)によってリング状の構造 (c-ring) が回転し、その回転が膜外の部分に伝わることでATPが合成されます(図1 左)。
しかし、これまで「プロトン駆動力が働いている最中の構造」を直接見ることはできませんでした。膜タンパク質は非常に扱いが難しく、従来の構造解析では膜から取り出した状態でしか解析できなかったためです。そのため、ATP合成酵素が本来の機能を発揮している状態での構造を明らかにするには、新しい手法の開発が必要でした。
■研究手法と成果:ATP合成酵素の“動く瞬間”を捉える
研究チームは、バクテリア由来のATP合成酵素と、光で水素イオンを運ぶ膜タンパク質「バクテリオロドプシン」を、人工的に作った擬似生体膜小胞(リポソーム)に組み込みました。光を当てると、バクテリオロドプシンが水素イオンを小胞内に運び込み、その結果、膜を挟んだプロトン駆動力が発生します(図1 中)。この状態でATPの材料であるADPとリン酸を加えると、ATP合成酵素によるATP合成反応が起こります。
この反応が進行している瞬間を捉えるため、研究チームはリポソーム溶液を急速に凍結し、クライオ電子顕微鏡で観察しました。プロトン駆動力がない状態では、ATP合成酵素の触媒部位にADPが確認されました。プロトン駆動力がある状態では、触媒部位にATPが存在し、酵素が実際にATPを合成している構造が捉えられました(図1 右)。
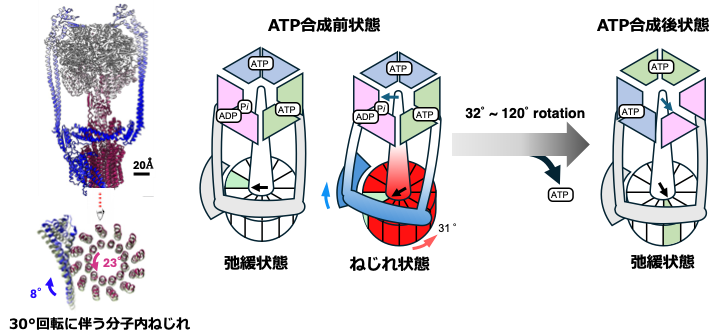
さらに、膜に埋まったリング状の部分が約30°回転した構造が確認され、その際、膜内部分と膜外部分の間に「ねじれ」が生じていることがわかりました(図2 左)。このねじれは、回転運動が分子内で一度ねじれに変換され、その力が膜外部分の構造変化を引き起こし、ATP合成反応を進めることを示唆しています(図2 右)。
重要なのは、この「分子内ねじれ」は、従来の界面活性剤で可溶化した状態では観察されなかった現象だということです。今回の成果は、リポソームを使った新しい膜タンパク質の構造解析手法の有用性を強く示しています。
■今後の展望と医薬分野への応用
多くの薬の標的となる膜タンパク質は、生体膜に埋め込まれ、生体膜を挟んだプロトン駆動力やイオン濃度の差による膜電位のもとで働いています。薬の設計に必要な構造情報は、この「本来の状態」で得られることが理想ですが、従来の技術では不可能でした。現在知られている膜タンパク質の構造のほとんどは、界面活性剤で膜から取り出し、水に溶ける状態で解析されたものです。そのため、それが自然な構造なのか、確証はありません。
今回の研究で示した手法は、その理想に一歩近づくものです。膜タンパク質が膜電位のもとで機能している「ありのままの姿」を捉えることが可能になれば、薬剤標的膜タンパク質の理解が飛躍的に進みます。これにより、より効果的な薬剤設計が可能になり、医療に大きな革新をもたらすでしょう。
■研究プロジェクトについて
本研究は、日本学術振興会科学研究費助成事業(23H02453 [横山]、20K06514 [岸川])、武田科学振興財団 [横山]、AMED創薬等ライフサイエンス研究支援基盤事業(BINDS)の支援を受けて行われました。
<用語解説>
1). ATP (adenosine triphosphate)
様々な生体反応にエネルギー源として使われるため、細胞のエネルギー通貨とも呼ばれる。ヒトをはじめ多くの生物では、ATP合成のほとんどはATP合成酵素によって担われている。
2). ATP合成酵素 (ATP synthase)
ATPの合成を担うタンパク質。真核生物の場合、ミトコンドリア内膜、細菌の場合は細胞膜に存在する。膜に埋まった部分で、生体膜内外に形成されたpH差を回転に変換し、膜から突き出た部分で回転力を使ってATPを合成する(図1)。回転によって反応を行うため、回転分子モーターとも呼ばれる。今回の研究では、V/A-ATPaseとよばれるATP合成酵素を材料とした。安定であり、構造解析に適した試料である。
3). 膜タンパク質 (Membrane proteins)
その一部、または全体が生体膜の中に埋まっているタンパク質。細胞内外の情報伝達や物質の輸送などに関わる。タンパク質全体の約3割が膜タンパク質である。
4). クライオ電子顕微鏡法 (cryo electron microscopy)
急速凍結したタンパク質などの生体試料に電子線を照射し、透過型電子顕微鏡を用いて試料の観察を行う。得られた2次元像から画像解析により、3次元再構成を行い、生体分子の立体構造を決定する。
|
【研究に関するお問い合わせ先】 |
【研究に関するお問い合わせ先】
京都産業大学 生命科学部 教授 横山 謙(よこやま けん)
高輝度光科学研究センター 回折・散乱推進室
主幹研究員・コーディネーター 重松 秀樹(しげまつ ひでき)
大阪大学 超高圧電子顕微鏡センター
教授 光岡 薫(みつおか かおる)
京都工芸繊維大学 応用生物学系
准教授 岸川 淳一(きしかわ じゅんいち)
【報道に関するお問い合わせ先】
京都産業大学 広報部
TEL:075-705-1411
E-mail:kouhou-bu star.kyoto-su.ac.jp
star.kyoto-su.ac.jp
理化学研究所 広報部 報道担当
TEL:050-3495-0247
E-mail:ex-press ml.riken.jp
ml.riken.jp
高輝度光科学研究センター
利用推進部 普及情報課
TEL:0791-58-2785
E-mail:このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。
大阪大学 工学研究科 総務課評価・広報係
TEL:06-6879-7231
E-mail: kou-soumu-hyoukakouhou office.osaka-u.ac.jp
office.osaka-u.ac.jp
京都工芸繊維大学 総務企画課 広報係
TEL: 075-724-7016
E-mail: kit-kisya jim.kit.ac.jp
jim.kit.ac.jp
(SPring-8 / SACLAに関すること)
公益財団法人高輝度光科学研究センター
利用推進部 普及情報課
TEL:0791-58-2785 FAX:0791-58-2786
E-mail:このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。