神経・腎疾患をもたらす酸化還元タンパク質の構造揺らぎ
-チオレドキシンの突然変異が疾患の原因となる仕組みを解明-
2025年10月6日
理化学研究所
岡山大学
日本原子力研究開発機構
総合科学研究機構
|
理化学研究所(理研)放射光科学研究センター生物系ビームライン基盤グループの竹下浩平研究員、岡山大学学術研究院教育学域の大守伊織教授、日本原子力研究開発機構物質科学研究センター強相関材料物性研究グループの中川洋研究主幹、総合科学研究機構中性子科学センターの岡﨑伸生副主任技師らの共同研究グループは、体内で酸化還元反応の調節に重要な働きを担うタンパク質「チオレドキシン」の突然変異が脳神経変性や慢性腎臓病の原因となる仕組みを、機能解析とX線結晶構造解析[1]、分子動力学シミュレーション[2]を駆使し、初めて解明しました。
論文情報 |
【背景】
チオレドキシンは、あらゆる生物に存在する酸化還元タンパク質で、細胞内のタンパク質の酸化状態を調節する「電子供与体」として働きます。DNA合成や抗酸化防御、細胞死の制御など、多様な生命現象を支える不可欠な因子です。これまでにラットでチオレドキシンの点突然変異(F54L変異)[3]が見つかり、この変異により若齢期の脳神経変性や加齢に伴う腎障害が生じることが報告されていました。しかし、なぜ、たった1カ所のアミノ酸の変化が、これほど大きな影響を与え、それらの疾患を引き起こすのか、その仕組みは不明でした。
【研究手法と成果】
今回、共同研究グループは、野生型とF54L変異型ラットチオレドキシンについて、酵素活性測定、熱安定性試験、X線結晶構造解析、分子動力学シミュレーションを組み合わせ、F54L変異と疾患の関係について解析を行いました。その結果、変異型は酸化還元電位に大きな差はないものの、本来の還元作用が著しく低下しており、特にインスリン還元能は、アミノ酸配列に変異のない本来の機能を有している正常な状態(野生型)の約3分の1にとどまることが明らかになりました。また、野生型がラットの体温域で安定しているのに対し、変異型は37℃で約4.5時間、40℃では約1.5時間で構造が崩れ始めるなど、体内環境で不安定であることが示されました。
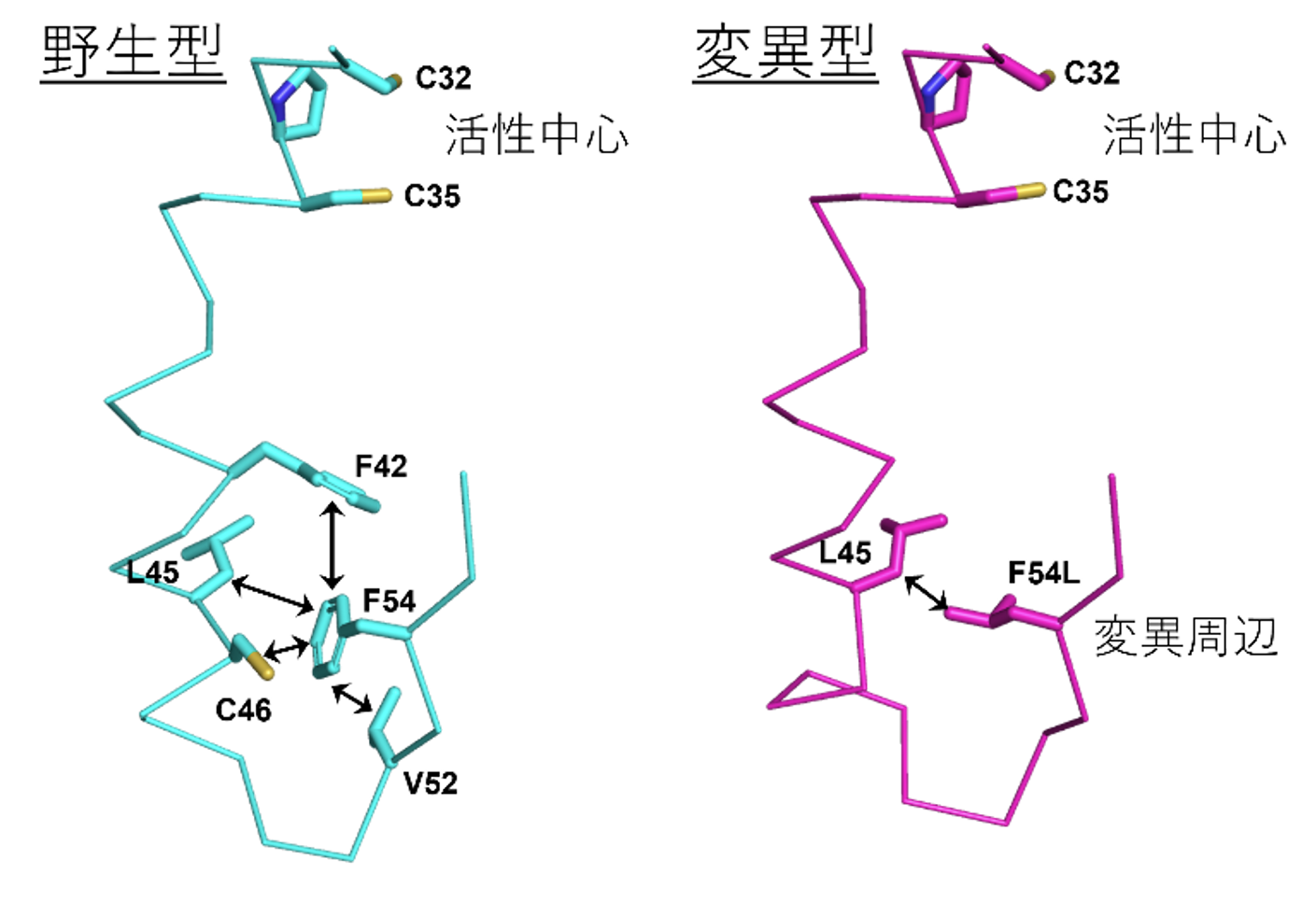
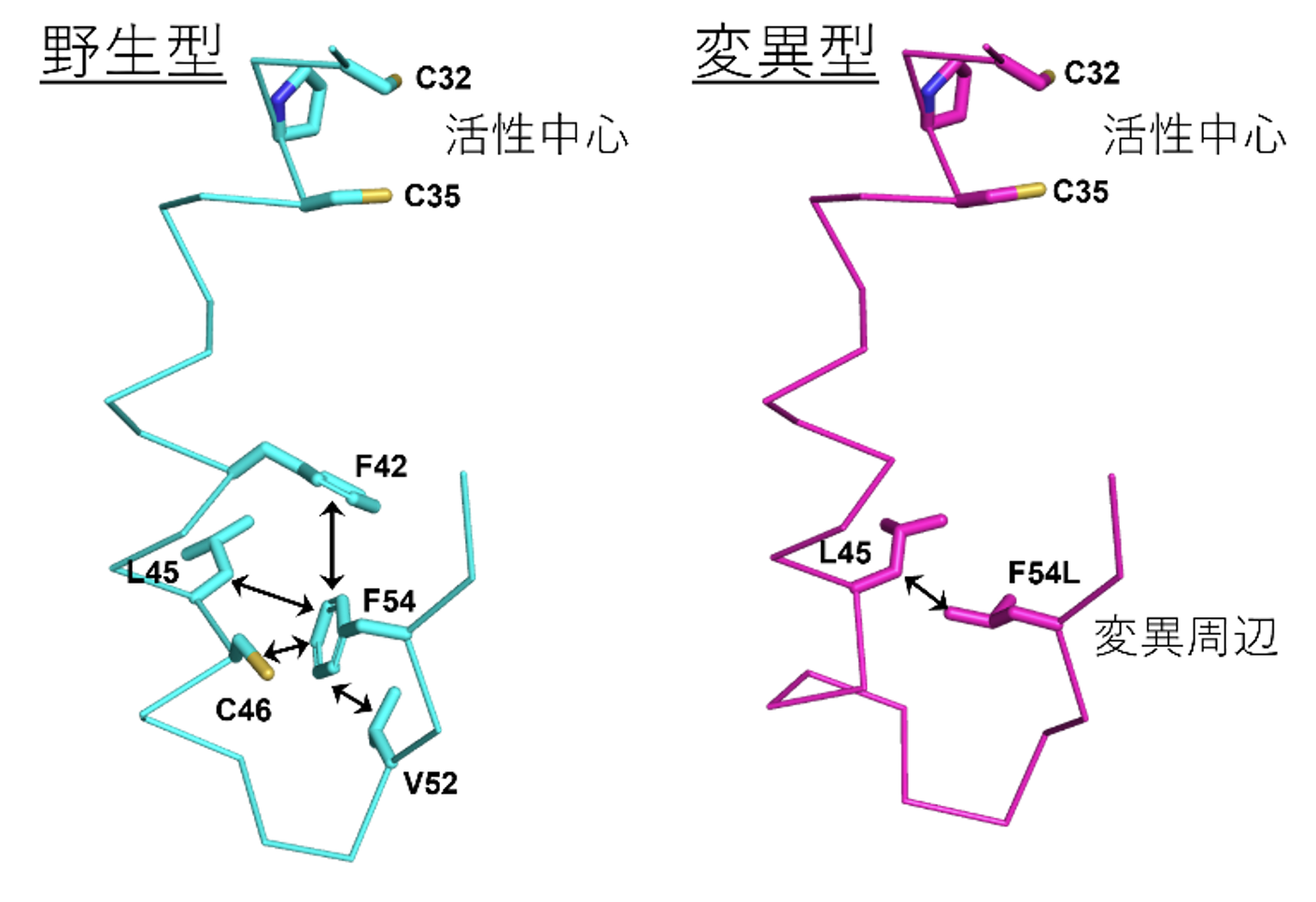
このような変異による活性の低下や不安定化を調べるために、大型放射光施設「SPring-8」[4]のBL26B2ビームラインを用いてX線結晶構造解析を行い、その結果、全体構造に大きな違いは認められなかったものの、野生型で構造安定化に寄与するF54残基の相互作用が変異型では消失しており(図1)、その結果、構造が揺らぎやすくなっている可能性が示唆されました。
図1 ラットチオレドキシンの変異周辺および活性中心付近の結晶構造
野生型(左)およびF54L変異型(右)のラットチオレドキシンの結晶構造(変異周辺および活性中心を含む一部)。野生型ではF54は周辺のアミノ酸残基と疎水性相互作用を形成しているが、変異型ではそれらの相互作用は消失している。またF54/F54Lからヘリックスを介して活性中心が配置している。C:システイン、F:フェニルアラニン、L:ロイシン、V:バリン(いずれもアミノ酸)。
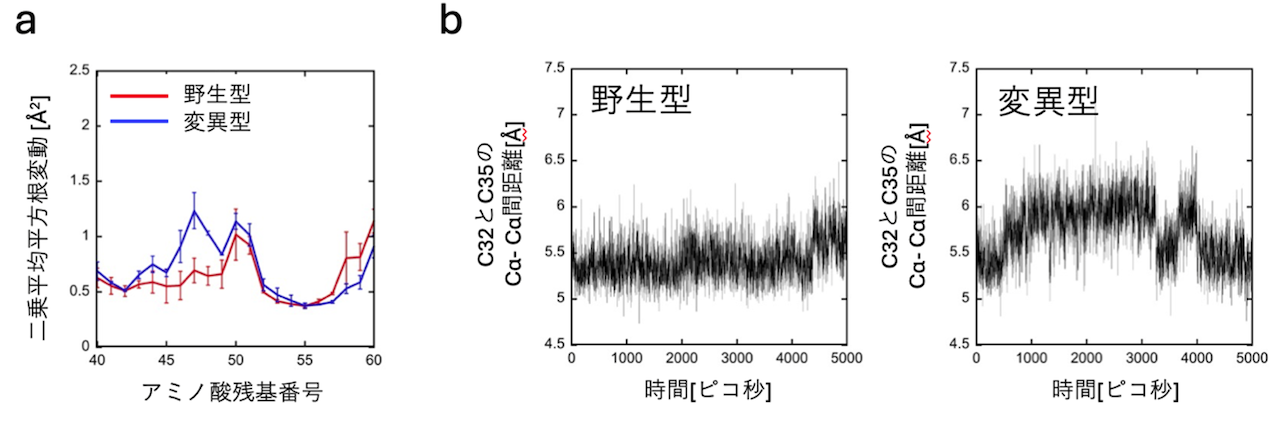
この可能性を確認するために、分子動力学シミュレーション解析を行うことで、F54L変異周辺の揺らぎが大きくなっていることが証明され、F54L変異によってチオレドキシンの構造が不安定化することが明らかになりました(図2a)。さらに、変異型ではその変異箇所からつながるヘリックス(らせん構造)の先に存在する活性中心の32番目と35番目のシステイン(C)残基の距離が広がる傾向が確認され(図2b)、この微小な変化が活性低下の一因と考えられました。
図2 分子動力学シミュレーションの結果
(a) 変異型(青線)ではF54L変異周辺の揺らぎの二乗平均平方根変動(単位:Å2、1Åは100億分の1メートル)の値が野生型(赤線)より大きくなっていることから、その周辺の揺らぎが大きくなっていることが分かる。
(b) F54/F54Lからヘリックスを介して配置する触媒中心の32番目および35番目のシステイン残基(C32およびC35)のCα-Cα間の距離(Cαはタンパク質中のアミノ酸のカルボキシル基に最も近い炭素原子であり、最も立体構造に影響を与える主鎖の一部。)の揺らぎが、F54L変異が入ることで大きくなっていることが分かる。ピコ秒:1兆分の1秒。
【今後の期待】
今回の研究により、チオレドキシン変異が疾患を引き起こす原因を分子レベルで説明できるようになりました。今後は、炎症やアポトーシス(遺伝的にプログラムされた細胞死)に関与する他の標的分子(ASK-1やNF-κBなど)との関係をさらに調べることで、神経変性疾患や腎疾患の新しい治療戦略につながることが期待されます。また、ラットチオレドキシンのF54L変異は、これまでにラット特有の疾患表現型と関連づけられており、ヒトでは同様の症例は報告されていません。しかしながら、変異の対象となるF54残基はヒトのチオレドキシンにおいても同じ位置に存在しています。このことは、F54残基がヒトのチオレドキシンにおいても構造的または機能的に重要な役割を担っている可能性を示唆しており、F54L変異が引き起こす分子機構の解明は、ヒトにおける酸化ストレス関連疾患やチオレドキシンの機能異常に起因する病態の理解・治療法の開発にも貢献することが期待されます。ラットモデルを通じた本変異の研究は、今後、ヒト疾患への新たな知見の獲得や、チオレドキシンを標的とした治療戦略の構築につながる可能性を秘めています。
【用語解説】
[1] X線結晶構造解析
対象とする分子などの結晶を作製し、その結晶にX線を照射して得られる回折データを解析することで、物質内部の原子の立体的な配置を調べる方法。この方法によって、タンパク質などの複雑な分子の立体構造を詳細に知ることができる。
[2] 分子動力学シミュレーション
原子や分子を質点として扱い、古典力学のニュートン方程式を数値的に解くことで、分子の動きや系の時間的な振る舞いを追跡し、物質の物性を解析する手法。
[3] チオレドキシンの点突然変異(F54L変異)
点突然変異とはDNAあるいはRNAの1塩基が別の塩基に置き換わったもの。F54L変異は点突然変異によってアミノ酸のフェニルアラニン(F)がロイシン(L)に置換されたアミノ酸変異。
[4] 大型放射光施設「SPring-8」
理研が所有する、兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す施設。SPring-8(スプリングエイト)の名前はSuper Photon ring-8 GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細くて強力な電磁波のこと。SPring-8では、遠赤外線から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光が得られるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。
【共同研究グループ】
理化学研究所 放射光科学研究センター
利用技術・システム開発研究部門
生物系ビームライン基盤グループ
研究員 竹下浩平 (タケシタ・コウヘイ)
研修生(研究当時) 馬場匠望 (ババ・タクミ)
専任技師 上野 剛 (ウエノ・ゴウ)
研修生(研究当時) 大恵千翔 (オオエ・チカ)
客員技師 佐治 淑 (サジ・シュク)
客員技師 山本祥子 (ヤマモト・サチコ)
部門長 山本雅貴 (ヤマモト・マサキ)
岡山大学 学術研究院
教育学域
教授 大守伊織 (オオモリ・イオリ)
医歯薬学域 病態生理・創薬学
准教授 大内田 守(オオウチダ・マモル)
日本原子力研究開発機構
物質科学研究センター 強相関材料物性研究グループ
研究主幹 中川 洋 (ナカガワ・ヒロシ)
総合科学研究機構 中性子科学センター
副主任技師 岡﨑伸生 (オカザキ・ノブオ)
【研究支援】
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「酸化ストレスによる神経細胞死とてんかん発症機序に関する多層オミックス解析(研究代表者:大守伊織)」、日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(SPring-8/SACLAにおけるタンパク質立体構造解析の支援および高度化)(研究代表:山本雅貴)」による助成を受けて行われました。
|
発表者・機関窓口 |
発表者・機関窓口
<研究に関すること>
理化学研究所 放射光科学研究センター 生物系ビームライン基盤グループ
研究員 竹下浩平 (タケシタ・コウヘイ)
岡山大学 学術研究院 教育学域
教授 大守伊織 (オオモリ・イオリ)
日本原子力研究開発機構 物質科学研究センター 強相関材料物性研究グループ
研究主幹 中川 洋 (ナカガワ・ヒロシ)
総合科学研究機構 中性子科学センター
副主任技師 岡﨑伸生 (オカザキ・ノブオ)
<機関窓口>
理化学研究所 広報部 報道担当
Email: ex-press ml.riken.jp
ml.riken.jp
岡山大学 総務部広報課
Email: www-adm adm.okayama-u.ac.jp
adm.okayama-u.ac.jp
日本原子力研究開発機構 総務部報道課
Email: tokyo-houdouka jaea.go.jp
jaea.go.jp
総合科学研究機構 利用推進部 広報担当
Email: press cross.or.jp
cross.or.jp
(SPring-8 / SACLAに関すること)
公益財団法人高輝度光科学研究センター
利用推進部 普及情報課
TEL:0791-58-2785 FAX:0791-58-2786
E-mail:このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。