パラインフルエンザウイルスが感染細胞から出芽する メカニズムを解明
~新規抗ウイルス薬開発への応用展開~
2021年9月7日
広島大学
【本研究成果のポイント】
●ウイルスのC蛋白質(※1)が宿主因子Alix(※2)と結合してできる複合体の三次元構造を明らかにしました。
●この三次元構造を基にして、感染させた動物細胞からウイルスが出芽する仕組みを解明しました。
●今回の研究成果により、C蛋白質を標的とした抗ウイルス薬の開発が現実的になりました。
広島大学大学院医系科学研究科の小田康祐助教と坂口剛正教授は、小児や高齢者に重篤 な呼吸器疾患を引き起こすヒトパラインフルエンザウイルス(※3)が感染細胞から出芽する仕組みを、近縁なセンダイウイルス(※4)を用いて明らかにしました。 ウイルスのC蛋白質は宿主因子のAlixと直接結合しますが、様々な制約のためC蛋白質に変異を入れたウイルスを作出することは難しく、なぜ結合するのかは長い間不明のままでした。本研究では、C蛋白質とAlixの複合体構造を原子レベルで明らかにし、その成果としてAlixと結合しないC蛋白質をもつウイルスを作出することが可能になりました。作出した変異ウイルスを用いて解析し、C蛋白質がAlixを細胞質膜上のウイルス出芽部位にリクルートすることで、ウイルスが感染細胞から出芽することを突き止めました。また今回C蛋白質とAlixの複合体構造を明らかにしたことで、C蛋白質を標的とした抗ウイルス薬の開発が現実的になりました。 <発表論文>
●論文タイトル「Structural Insight into the Interaction of Sendai Virus C Protein with Alix To Stimulate Viral Budding」 |
【背景】
パラインフルエンザウイルスの感染によって引き起こされる急性呼吸器感染症は、5歳以下の乳幼児において主たる死因のひとつです。特に発展途上国では重要なウイルス感染症です。現在では治療方法がステロイド剤の吸入など対症療法しかなく、ウイルスの感染をコントロールできる薬剤の開発が望まれています。
パラインフルエンザウイルスは、感染した細胞のなかでC蛋白質を産生し、ウイルスの増殖を助けます。C蛋白質は宿主因子STAT1(※5)と結合することで、インターフェロン(※6)の作用からウイルスを逃がします。また、宿主因子Alixとも結合することがわかっていました。一方、ウイルスのゲノムRNA上のC蛋白質がコードされる遺伝子領域から、C蛋白質以外に、P、V蛋白質も産生されます。このため、P、V蛋白質に変異を入れずに、C蛋白質の特定の機能だけを変えたウイルスの作出は困難であり、C蛋白質と宿主因子Alixの結合の意義は長い間不明のままでした。
【研究成果の内容】
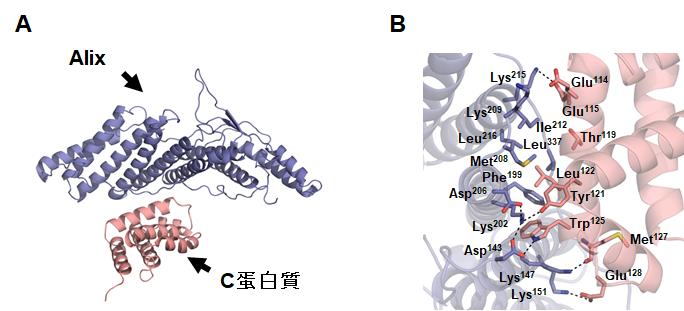
どのようにウイルスのゲノムRNAに変異を入れれば、目的とするウイルスを作出できるのかを調べるため、センダイウイルスのC蛋白質がAlixと結合してできる複合体の三次元構造を、大型放射光施設SPring-8での実験を経て明らかにしました(図1)。その成果として、C蛋白質の125番目のアミノ酸残基であるトリプトファンをロイシンに置換するように変異を入れることで、Alixと結合しないC蛋白質をもつウイルスを作出できることが明らかになりました。作出したウイルスは、感染細胞からの出芽率が著しく減少していました。
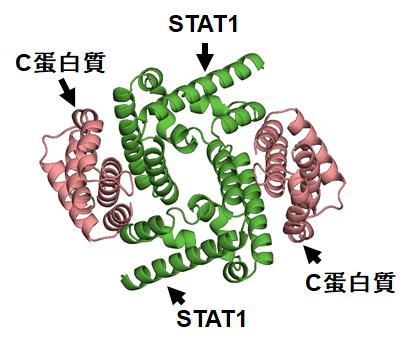
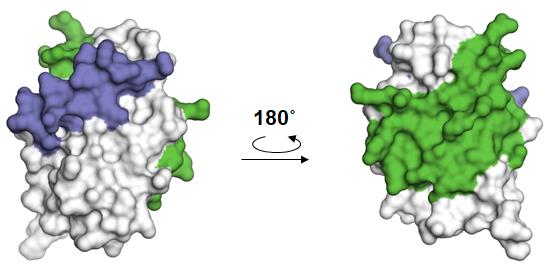
また、私たちは以前の研究で、C蛋白質とSTAT1の複合体構造を明らかにしています(図2)。今回決定した構造と比べると、C蛋白質は分子表面上の全く異なる領域を用いて、AlixやSTAT1と結合することが分かりました(図3)。C蛋白質が標的因子(AlixやSTAT1)に結合することを妨げる化合物は、抗ウイルス薬になりえます。
一方で、標的因子と結合していないC蛋白質は構造が不安定なので、単独で構造を解析することが困難です。このため、C蛋白質に結合しAlixとの結合を妨げる化合物を取得できたとしても、構造の不安定なC蛋白質だけでは化合物がC蛋白質とどのように結合するかを明らかにすることはできません。このとき、STAT1に結合したC蛋白質を用いることで、C蛋白質が安定化し、化合物とC蛋白質の結合を解析することが可能であることがわかりました。これによって、化合物がどのように結合するのかを解析することで有効な薬剤を合理的に設計できるようになります。
【今後の展開】
インフルエンザウイルスのような特定の急性呼吸器感染症と異なり、パラインフルエンザウイルスのような風邪の原因となるウイルスではワクチンの開発は難しく、有効な薬剤もまだ開発されていません。
しかしながらパラインフルエンザウイルスは小児だけではなく、免疫不全者、造血幹細胞移植患者では感染すれば重篤化しやすく、治療薬を開発する必要があります。C蛋白質を失わせたウイルスは病原性が著しく減少するため、C蛋白質は治療薬開発の標的として有望です。現在、私たちのグループはC蛋白質を標的とした薬剤の開発研究を進めており、センダイウイルスの増殖を阻害する化合物も得られてきています。これまでに私たちが決定してきたC蛋白質の三次元構造を利用し、有効な抗ウイルス薬の開発を試みていきます。
図1.(A)C蛋白質のC末領域とAlixのN末端ドメインの複合体構造。(B)C蛋白質とAlix間の結合様式。
図2.C蛋白質のC末領域とST AT1のN末端ドメインの複合体構造。
図3.C蛋白質(C末領域の分子表面上におけるAlix(青)およびSTAT1(緑)との接触領域のマッピング)
<用語説明>
(※1)C蛋白質
ヒトパラインフルエンザウイルスおよびセンダイウイルスといった、パラミクソウイルス科レスピロウイルス属がもつ蛋白質であり、インターフェロンに対抗するなどしてウイルスの増殖を増強するアクセサリー蛋白質。
(※2)Alix
宿主の多小胞体形成や、細胞基質分裂など膜リモデリングに関わるESCRT (Endosomal Sorting Complex Required for Transport)関連因子のひとつ。一部のエンベロールウイルスは感染細胞からの出芽にESCRT機構を利用する。
(※3)ヒトパラインフルエンザウイルス
ヒトに感染するパラインフルエンザウイルス。1~4型があり、このうち1型と3型がパラミクソウイルス科レスピロウイルス属に分類される。小児気管支炎、肺炎、クループ症候群を起こす。
(※4)センダイウイルス
マウスに感染するパラインフルエンザウイルス。ヒトパラインフルエンザウイルス1型と抗原が交差するほど近縁である。
(※5)STAT1 (Signal Transducers and Activators of Transcription 1)
細胞表面のインターフェロン受容体にインターフェロンが結合すると、細胞質のSTAT1がリン酸化され、核内に入って染色体DNAに結合して、抗ウイルス状態誘導などに必要な蛋白質を合成する転写を活性化する。
(※6)インターフェロン
ウイルスならびに腫瘍に対抗するサイトカイン。身体へのウイルスの侵入によって分泌される。現在は人工的に 調製してC型肝炎の治療などに用いられている。
【お問い合わせ先】 |
【お問い合わせ先】
大学院医系科学研究科 小田 康祐
TEL:082-257-5157 FAX:082-257-5159
E-mail:kosuke-81 hiroshima-u.ac.jp
hiroshima-u.ac.jp
(SPring-8 / SACLAに関すること)
公益財団法人高輝度光科学研究センター
利用推進部 普及情報課?
TEL:0791-58-2785
FAX:0791-58-2786
E-mail:このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。